Cách tính số oxi hoá và xác định số oxi hóa của một nguyên tố trong hợp chất hoá học là kiến thức quan trọng môn Hóa mà các bạn học sinh cần nắm vững. Qua đó giúp bạn dễ dàng áp dụng vào việc giải bài tập hóa hiện nay.
Số Oxi hóa là gì?
Số oxi hóa của một nguyên tố là điện tích của nguyên tử nguyên tố đó trong một phân tử, nếu giả định rằng liên kết giữa các nguyên tử trong phân tử là liên kết ion.

Xem thêm Hóa trị là gì? Quy tắc và Bảng hóa trị các nguyên tố hóa học
Cách xác định số Oxi hoá của ion trong 1 nguyên tố
Người ta thường dùng khái niệm số oxi hóa phục vụ cho việc nghiên cứu phản ứng oxi hóa – khử.
Trong mỗi nguyên tố thì số oxi hóa trong phân tử được tính bằng điện tích của nguyên tử nguyên tố đó trong phân tử, trường hợp liên kết giữa các nguyên tử trong phân tử là liên kết ion.
Cách xác định số oxi hóa của hợp chất theo những quy tắc dưới đây:
Theo bạn tư vấn tuyển sinh Cao đẳng Y Khoa Phạm Ngọc Thạch, dưới đây là 4 quy tắc xác định số oxy hóa của hợp chất:
Quy tắc 1: Số oxi hóa của nguyên tố trong đơn chất bằng 0.
Ví dụ: O2, H2, N2, Cu, Zn,…
Quy tắc 2: Tổng số oxi hóa của các nguyên tố trong một phân tử bằng 0.
Ví dụ: MgO (Mg:+2 ; O:-2) ta có 2-2=0
Quy tắc 3: Số oxi hóa của ion đơn nguyên tử bằng điện tích của ion đó. Còn với các ion đa nguyên tử, thì tổng số oxi hóa của các nguyên tố được tính bằng điện tích của ion.
Ví dụ: Mg2+ có số oxi hóa là +2; còn phân tử NO3– có số oxi hoá -1 bởi số oxi hóa của N là +5, còn số oxi hóa O là -2.
Quy tắc 4:
– Trong hầu hết các hợp chất số oxi hóa của H là +1 (trừ những hợp chất của H với kim loại gồm NaH, CaH2, thì số oxi hóa của H là –1).
Ví dụ: H2O, HCl
– Trong đa số hợp chất số oxi hoá của O: -2 (ngoại trừ một số hợp chất như H2O2, Na2O2, F2O oxi có số oxi hóa lần lượt gồm : –1, -1, +2)
Ví dụ: H2O , Na2O ,CO2
– Với Halogen (đối với F có số oxi hóa là -1).
+ Kết hợp với H và kim loại số oxi hóa thường là: -1
Ví dụ: HCl , NaCl , NaBr, FeCl3
+ Khi đi với O thì có số oxi hóa là: +1 ; +3 ; +5 ; +7
Ví dụ: HClO (Cl:+1); KClO2 (Cl:+3); KClO3 (Cl:+5); HClO4 (Cl:+7).
– Với lưu huỳnh:
+ Nếu đi với H hoặc Kim loại thì có số oxi hóa là: -2
Ví dụ : H2S, Na2S
+ Nếu đi với O thì có số oxi hóa là: +4 ; +6
Ví dụ : SO2 , SO3
– Đối với kim loại:
Nhóm IA: có số oxi hóa là +1
Nhóm IIA: có số oxi hóa là +2
Nhóm IIIA: có số oxi hóa là +3
Cách tính số Oxi hoá của một nguyên tố
Ví dụ: Cho các hợp chất amoniac (NH3), axit nitrơ
(HNO2), và anion NO3−. Hãy tính số oxi hóa của nguyên tố Nito trong hợp chất trên
Hướng dẫn: Trước tiên, ta gọi số oxi hóa của nguyên tố nitơ trong các hợp chất và ion là x. Ta có:
Trong hợp chất NH3: x + 3.(+1) = 0 ⇒ x = -3
Trong hợp chất HNO2: (+1) + x + 2.(-2) = 0 ⇒ x = -3
Trong hợp chất NO3−: x + 3.(-2) = -1 ⇒ x = +5
* Cách ghi số oxi hóa: Thường, số oxi hóa sẽ được đặt phía trên kí hiệu của nguyên tố, dấu trước và số sau.
Xem thêm Bảng tuần hoàn các nguyên tố hóa học mới và đầy đủ nhất
3. Bài tập về cách xác định số oxi hoá trong ion và hóa trị
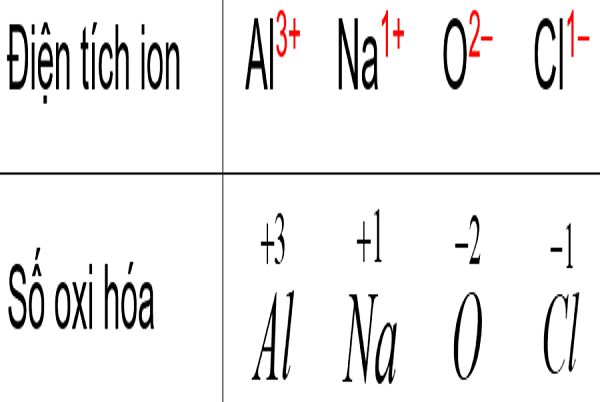
Câu hỏi 1: Hãy tính điện hóa trị của các nguyên tử trong những hợp chất dưới đây: CsCl, Na2O, BaO, BaCl2, Al2O3.
Lời giải:
Cs = 1+; Cl = 1–; Na = 1+; O = 2–; Ba = 2+; O = 2–
Ba = 2+; Cl = 1–; Al = 3+; O = 2–
Câu hỏi 2: Xác định cộng hóa trị của những nguyên tố trong các hợp chất dưới đây: H2O, CH4, HCl, NH3.
Câu hỏi 3: Tính cộng hóa trị của các nguyên tố trong hợp chất sau đây:
- Hợp chất H2O: H có cộng hóa trị là 1. O có cộng hóa trị là 2
- Hợp chất CH4: C có cộng hóa trị là 4. H có cộng hóa trị là 1
- Hợp chất HCl: H và Cl đều có cộng hóa trị là 1
- Hợp chất NH3: N có cộng hóa trị là 3. H là cộng hóa trị là 1
Câu hỏi 4: Hãy tính số oxi hóa của các nguyên tố trong các phân tử và ion dưới đây: NO, CO2, Cu2+, H2O, SO3, NO, NO2, Na+, NH3, Fe2+, Fe3+, Al3+.
Lời giải:
* Ta biết O có số oxi hóa là -2, và H có số oxi hóa là + 1
⇒ Số oxi hóa của các nguyên tố trong các phân tử và ion như sau:
CO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ C trong CO2 sẽ có số oxi hóa là +4
H2O: H có số oxi hóa là +1, còn O có số oxi hóa là -2.
SO3: x + 3.(-2) = 0 ⇒ x = 6 ⇒ Nguyên tử S trong SO3 có số oxi hóa +6
NH3: x + 3.1 = 0 ⇒ x = -3 ⇒ N trong phân tử NH3 có số oxi hóa là -3
NO: x + 1.(-2) = 0 ⇒ x = 2 ⇒ N trong phân tử NO có số oxi hóa là +2
NO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ N trong NO2 có số oxi hóa +4
Cu2+ có số oxi hóa là +2.
Fe3+ có số oxi hóa là +3.
Na+ có số oxi hóa là +1.
Fe2+ có số oxi hóa là +2.
Al3+ có số oxi hóa là +3.
Câu hỏi 5: Hãy viết công thức phân tử của các chất, trong đó S lần lượt sẽ có số oxi hóa là -2, 0, +4, +6.
Lời giải:
– Công thức phân tử của các chất trong đó S có số oxi hóa là bao nhiêu? Theo đó trong các hợp chất H2S, S, SO2, SO3 thì S có số oxi hóa lần lượt là -2, 0, +4, +6.
Câu hỏi 6: Cách xác định số oxi hóa của các hợp chất, đơn chất và của ion trong các ví dụ dưới đây:
- a) H2S, S, H2SO3, H2SO4.
- b) HCl, HClO, NaClO2, HClO3, HClO4.
- c) Mn, MnCl2, MnO2, KMnO4.
- d) MnO4–, SO42-, NH4+.
Lời giải:
a) Số oxi hóa của O là -2, H có số oxi hóa +1 trong các hợp chất.
⇒ Số oxi hóa của S trong các chất trên như sau:
H2S: 1.2 + x = 0 ⇒ x = -2 ⇒ S có số oxi hóa là -2 trong H2S
S đơn chất có số oxi hóa 0
H2SO3: 1.2 + x + 3.(-2) = 0 ⇒ x= 4 ⇒ S có số oxi hóa +4 trong H2SO3
H2SO4: 1.2 + x + 4.(-2) = 0 ⇒ x = 6 ⇒ S có số oxi hóa +6 trong H2SO4
b) Số oxi hóa của Cl trong các hợp chất là:
HCl , HClO, NaClO2, HClO3, HClO4 lần lượt là -1, +1, +3, +5, +7
c) Cách xác định số oxi hóa của Mn trong hợp chất chất lần lượt bao gồm:
Mn, MnCl2, MnO4, KMnO4 lần lượt là: 0, +2, +4, +7
d) Cách tính số oxi hóa của hợp chất MnO4–, SO42-, NH4+: là Mn+7 , S+6, N-3
Bài viết trên đây giúp bạn tìm hiểu về cách tính số oxi hóa và hóa trị nguyên tố ở trên rất hữu ích cho bạn đọc. Qua đó giúp các bạn vận dụng vào giải bài tập môn hóa học chính xác. Đừng quên theo dõi bài viết tiếp theo cập nhật kiến thức liên quan nhé.
Nguồn tổng hợp: Cao đẳng Y Khoa Phạm Ngọc Thạch





 Cách chọn khối thi Đại học phù hợp năng lực 2025
Cách chọn khối thi Đại học phù hợp năng lực 2025
 Top 10 Các Trường Cao đẳng Y Dược xét học bạ 2025
Top 10 Các Trường Cao đẳng Y Dược xét học bạ 2025
 Trường Cao đẳng Y khoa Phạm Ngọc Thạch có tốt không?
Trường Cao đẳng Y khoa Phạm Ngọc Thạch có tốt không?
 Nên học Điều dưỡng hay Hộ sinh để phát triển sự nghiệp?
Nên học Điều dưỡng hay Hộ sinh để phát triển sự nghiệp?
 Nên học Dược hay Điều dưỡng? Chọn ngành nào tốt hơn?
Nên học Dược hay Điều dưỡng? Chọn ngành nào tốt hơn?
 Ngành Tổ chức và Quản lý Y tế là gì? Ra trường làm gì?
Ngành Tổ chức và Quản lý Y tế là gì? Ra trường làm gì?

 Q. Tân Bình: Số
Q. Tân Bình: Số  Điện thoại: 0899 955 990 (Cô Nhung) | 0969 955 990 (Cô Huệ) | 0933519898 (Cô Yến) | 0961539898
Điện thoại: 0899 955 990 (Cô Nhung) | 0969 955 990 (Cô Huệ) | 0933519898 (Cô Yến) | 0961539898 Email:
Email: 



