Mol là một thuật ngữ được nhiều người nhắc đến trong ngành hóa học, một thuật ngữ được dùng rộng rãi trên toàn cầu để đo đạc căn bản của hệ thống đo đạc quốc tế SI. Bài viết trên đây giúp bạn tìm hiểu về Mol là gì? Nồng độ mol là gì? Cách tính khối lượng và thể tích như thế nào, hãy cùng tìm hiểu dưới đây nhé.
1. Mol là gì?
1.1. Khái niệm Mol là gì?
Mol là viết tắt của mole, là đơn vị đo lường trong hóa học để diễn tả về lượng chất có chứa 6,022.1023 số hạt đơn vị nguyên tử hoặc phân tử chất đó. Số 6,02214129(27)×1023 còn được gọi là hằng số Avogadro (ký hiệu NA).

Ví dụ: 1 mol Fe hay được hiểu là 6.1023 nguyên tử Fe. 1 mol nguyên tử Oxi sẽ chứa 6,022. 1023 nguyên tử oxi. Đây là đơn vị cơ bản của hệ SI. Các phép biến đổi các đại lượng thì bạn có thể làm tròn là: N = 6,023.1023.
Khái niệm mol nguyên tử và mol phân tử thường không giống nhau.
- Mol nguyên tử của một nguyên tố: Lượng nguyên tố có chứa NA nguyên tử của nguyên tố đó.
- Mol phân tử của một chất: Đây là lượng chất chứa NA phân tử của chất đó.
1.2. Lịch sử ra đời nồng độ Mol
Lịch sử ra đời của đơn vị mol có mối liên hệ với những khái niệm đơn vị khối nguyên tử phân tử khối, hằng số Avogadro và những khái niệm có liên quan khác.
Vào năm 1805 thì John Dalton đã có ra đời bảng giá trị nguyên tử khối, dựa trên một hệ thống mà nguyên tử khối tương đối của hiđro được định nghĩa là bằng 1. Những giá trị trong bảng này dựa trên sự cân bằng hóa học lượng pháp trong hợp chất và trong phản ứng hóa học.
Jöns Jacob Berzelius (1779–1848) đã có nghiên cứu chính xác hơn nhiều về cách xác định nguyên tử khối. Đây cũng là nhà hóa học đầu tiên sử dụng giá trị nguyên tử khối ôxy để làm chuẩn.
Tiếp theo, các nhà hóa học tiếp theo là Charles Frédéric Gerhardt (1816–1856), Henri Victor Regnault (1810–1878) và Stanislao Cannizzaro (1826–1910) đã tiếp tục mở rộng công trình của Berzelius. Tại đại hội 1860, giới hóa học gia đã có quyết định quay về định nghĩa nguyên tử khối của hyđrô bằng 1. Kể cả mức độ đo lường thời điểm số có sai số khoảng 1% và giá trị này tương đương về mặt số học với giá trị chuẩn dựa trên ôxy sau này.
Trong bối cảnh xã hội tiến bộ, con người càng phải thôi thúc xác định nguyên tử khối chính xác thì ngành hóa học cũng có sự đòi hỏi thúc đẩy. Họ nhận ra được sự tiện lợi khi dùng ôxy làm chuẩn. Về sau thì họ cũng phải chấp nhận dùng nguyên tử khối của ôxy-16 làm chuẩn. Cho đến thập niên 1960, định nghĩa mol dựa trên cacbon-12.
1.3. Phân loại Mol
Nguyên tử, phân tử đều là những hạt có kích thước vi mô. Kích thước của chúng nhỏ hơn hạt cát hàng nghìn lần mà mắt thường không nhìn ra được. Do vậy, những hạt vĩ mô này không thể áp dụng đơn vị đo lường thông thường. Các nhà khoa học hiện tại cũng đã đề xuất ra một đơn vị đo lường mới dành cho các hạt vi mô này, đó là mol. Theo đó, khái niệm mol gồm 2 loại:
- Mol nguyên tử
- Mol phân tử
2. Khối lượng mol là gì?
Khối lượng mol của một chất được hiểu là khối lượng mol chất tính ra gam của N nguyên tử hay phân tử của chất đó. Trị số của khối lượng mol được tính bằng phân tử hoặc nguyên tử khối.
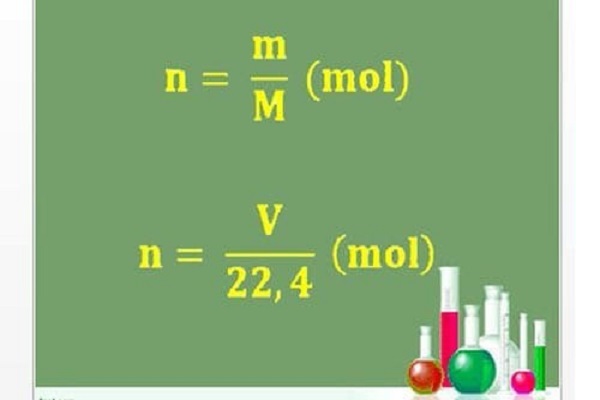
Lưu ý: Khối lượng mol của phân tử khác khối lượng mol của nguyên tử. Chẳng hạn như khối lượng mol phân tử hydro là 2g còn khối lượng mol của nguyên tử hydro chỉ là 1g.
2.1. Công thức tính khối lượng mol nguyên tử:
M = m / n
Trong đó:
- M là khối lượng mol, đơn vị (g/mol)
- m là khối lượng của chất đó, đơn vị (g)
- n là số mol chất, đơn vị (mol)
Ta có chẳng hạn sau:
- Khối lượng mol của 1 nguyên tử Oxi: M(O)=16g
- Khối lượng mol của 1 nguyên tử Hidro: M(H)=1g
- Khối lượng mol của 1 phân tử nước (HշO): M (HշO) = 16+2.1 = 18g
2.2. Cách tính khối lượng mol của phân tử và hợp chất
Khối lượng mol của một hợp chất hay phân tử gồm nguyên tử của những nguyên tố khác nhau bằng với tổng khối lượng mol số nguyên tử trong phân tử chất đó.
Xét trường hợp tổng quát đối với một hợp chất bất kỳ nào đó được cấu tạo bởi 3 nguyên tố hóa học với công thức hóa học là AaBbCc bao gồm:
– A, B, C là nguyên tố hóa học tạo nên hợp chất.
– a, b, c là số nguyên tử tương ứng với mỗi nguyên tố.
Do vậy, khối lượng mol của hợp chất trên sẽ được tính bằng công thức dưới đây:
Mhc = MA x a + MB x b + MC x c
Ví dụ: Tính khối lượng mol của hợp chất dưới đây
– Khối lượng mol của phân tử nước có công thức hóa học H2O là MH2O = MH2 + MO = (1 x 2 + 16) = 18 g/mol.
– Khối lượng mol của axit clohidric là MHCl = 1 + 35,5 = 36,5 g/mol
Khối lượng mol của một số chất:
- Khối lượng mol của không khí : M không khí là 29 mol/g
- Khối lượng mol của Nitơ: M(N) = 7 (g)
- Khối lượng mol của Ag: M(Ag) = 47 (g)
- Khối lượng mol của Iot: M(I) = 53 (g)
- Khối lượng mol của Bari: M(Ba) = 56 (g)
- Khối lượng mol của Kali: M(K) = 19 (g)
3. Thể tích mol chất khí là gì?
3.1. Thể tích mol của chất khí khái niệm là gì?
Thể tích mol phân tử của một chất khí hay còn được gọi là thể tích của 1 mol phân tử của chất khí đó. Theo cách dễ hiểu thì thể tích mol của chất khí được xem là thể tích chiếm bởi N phân tử chất đó.

Một mol của bất kỳ chất khí nào trong cùng điều kiện nhiệt độ, áp suất đều chiếm thể tích bằng nhau. Theo quy ước ở t = 0 °C & P = 1 atm (điều kiện tiêu chí ) thì 1 mol khí bất kể nào thì sẽ có thể tích là 22,4 lít.
Ví dụ: Sau 1 mol khí Hշ hoặc 1 mol khí Oշ hay bất kể khí nào thì đều có thể tích 22,4 lít.
3.2. Công thức tính mol chất khí xét ở điều kiện tiêu chí(đktc)
Công thức tính số Mol chất khí qua thể tích dưới đây:
Từ đó ta có công thức tính thể tích chất khí (đktc) khi biết số mol: V = n.22,4 (lít)
Trong số đó:
- n: số mol chất khí (mol)
- V: thể tích chất khí ở điều kiện tiêu chí (lít)
Với các chất khí ở điều kiện tự nhiên ( không ở điều kiện tiêu chí), thì sẽ không vận dụng công thức này để tính toán. Bạn có thể dùng công thức sau để tính số mol chất khí không trong điều kiện tiêu chí:
Trong số đó, ta có:
- P là Áp suất (atm)
- V là thể tích chất khí (lít)
- R=0.082
- T = 273+t độ C.
4. Nồng độ mol là gì?
Nếu biết số mol chất tan và thể tích dung dịch thì nồng độ mol sẽ được tính theo công thức dưới đây:
CM = nct / Vdd
- C là nồng độ % của dung dịch nhà cung cấp %;
- nct : số mol chất tan
- Vdd: thể tích dung dịch (lít)
Với những kiến thức trên đây giúp bạn tìm hiểu về Mol là gì? Tính khối lượng và nồng độ Mol như thế nào? Đừng quên những bài viết tiếp theo của trường Cao đẳng Y Khoa Phạm Ngọc Thạch để cập nhật kiến thức liên quan khác nhé. Chúc bạn thành công!





 Cách chọn khối thi Đại học phù hợp năng lực 2025
Cách chọn khối thi Đại học phù hợp năng lực 2025
 Top 10 Các Trường Cao đẳng Y Dược xét học bạ 2025
Top 10 Các Trường Cao đẳng Y Dược xét học bạ 2025
 Trường Cao đẳng Y khoa Phạm Ngọc Thạch có tốt không?
Trường Cao đẳng Y khoa Phạm Ngọc Thạch có tốt không?
 Nên học Điều dưỡng hay Hộ sinh để phát triển sự nghiệp?
Nên học Điều dưỡng hay Hộ sinh để phát triển sự nghiệp?
 Nên học Dược hay Điều dưỡng? Chọn ngành nào tốt hơn?
Nên học Dược hay Điều dưỡng? Chọn ngành nào tốt hơn?
 Ngành Tổ chức và Quản lý Y tế là gì? Ra trường làm gì?
Ngành Tổ chức và Quản lý Y tế là gì? Ra trường làm gì?

 Q. Tân Bình: Số
Q. Tân Bình: Số  Điện thoại: 0899 955 990 (Cô Nhung) | 0969 955 990 (Cô Huệ) | 0933519898 (Cô Yến) | 0961539898
Điện thoại: 0899 955 990 (Cô Nhung) | 0969 955 990 (Cô Huệ) | 0933519898 (Cô Yến) | 0961539898 Email:
Email: 



